Reaksi dalam Larutan
Konsentrasi Molar
Sering dibutuhkan penentuan
konsentrasi suatu larutan secara kuantitatif. Ada beberapa cara yang untuk
memperoleh konsentrasi larutan secara kuantitatis. Suatu istilah yang sangat
berguna dan berkaitan dengan stoikiometri suatu reaksi dalam larutan disebut
konsentrasi molar atau molaritas dengan simbol M. Dinyatakan sebagai jumlah mol
suatu zat terlarut (solut) dalam larutan dibagi dengan volume larutan yang ditentukan
dalam liter.
Larutan
yang mengandung 1 mol NaCl dalam 1 L larutan mempunyai molaritas 1 mol NaCl/(L
larutan) atau 1 M dan disebut 1 molar larutan.
Contoh soal
2,00 g natrium hidroksida, NaOH, dilarutkan dalam air dan
membentuk larutan dengan volume 200 ml. Berapa molaritas NaOH dalam larutan?
Solusi
Mol NaOH = 2/40 = 0,05 mol
V = 200 ml = 0,2 l
M = 0,05/0,2 = 0,250 M NaOH
Pengenceran
Dalam pekerjaan sehari-hari di laboratorium, biasanya
kita menggunakan larutan yang lebih rendah konsentrasinya dengan cara
menambahkan pelarutnya, misalnya banyak laboratorium kimia membeli larutan
senyawa kimia dalam konsentrasi yang pekat. Biasanya senyawa kimia yang dibeli
ini demikian pekatnya, sehingga larutan ini harus diencerkan. Proses
pengenceran adalah mencampur larutan pekat (konsentrasi tinggi) dengan cara
menambahkan pelarut agar diperoleh volume akhir yang lebih besar. Proses
pengenceran dapat dirumuskan secara singkat sbb:
Contoh soal
Berapa mililiter H2SO4 pekat (18,0
M) yang dibutuhkan untuk membuat 750 ml larutan larutan H2SO4 3,00
M.
Solusi
Contoh soal
Berapa banyak air yang harus ditambahkan ke dalam 25 ml
KOH 0,500 M agar diperoleh konsentrasi 0,350 M?
Solusi
Volume air harus ditambahkan = 35,7 – 25 = 10,7 ml
Stoikiometri
Reaksi dalam Larutan
Hubungan kuantitatif suatu reaksi dalam larutan tepat
sama dengan reaksi ini bila terjadi dimana saja. Koefisien dalam persamaan
reaksi merupakan perbandingan mol yang dibutuhkan untuk menyelesaikan soal
stoikiometrinya.
Contoh Soal:
Alumunium hidroksida, Al(OH)3, salah satu
komponen antasida, dapat dibuat dari reaksi alumunium sulfat, Al2(SO4)3 dengan
natrium hidroksida, NaOH. Persamaan reaksinya adalah:
Berapa mililiter larutan NaOH 0,200 M dibutuhkan untuk
direaksikan dengan 3,50 g Al2(SO4)3?
Solusi
Mr Al2(SO4)3 = 342,2
g/mol
Mol Al2(SO4)3 = 3,5
/342,2 = 1,02 x 10-2 mol
Mol NaOH = 6/1 x mol Al2(SO4)3
=6 x1,02 x 10-2 mol=6,12 x 10-2 mol
V NaOH = mol/Molaritas = 6,12 x 10-2 mol/0,200
M =0,306 l = 306 ml
Stoikiometri
Reaksi Fasa Gas
Menurut Avogadro, pada
suhu dan tekanan yang sama gas-gas bervolume sama mengandung jumlah molekul
yang sama pula. Hal itu juga berarti bahwa pada suhu dan tekanan yang sama
gas-gas dengan jumlah molekul yang sama akan mempunyai volume yang sama. Pada
kondisi tekanan 1 atm dan temperatur 0o C atau disebut juga dengan
keadaan standar (Standard Temperature and
Pressure) volum 1 mol gas adalah 22,4 liter.





.jpg)



.jpg)




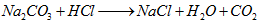




.jpg)

